기체, 액체, 고체의 상태가 아무리 변하더라도 질량은 절대로 변하지 않는다!
이유는 개수가 변하지 않기 때문입니다.
즉, 몰과 질량 편에서 몰과 질량의 관계는 고체, 액체, 기체 모든 상태에서 가능합니다.
하지만 몰과 부피의 관계에서는 이야기가 달라집니다.
[몰과 부피]의 관계는 오로지 기체에서만 가능합니다.
| * 아보가드로법칙 이 세상의 모든 기체(종류에 상관없이)는 같은 온도, 같은 압력, 같은 부피속에는 같은 분자수가 있다. (같은 원자수가 아니라는 것을 염두에 두어야 한다.) |
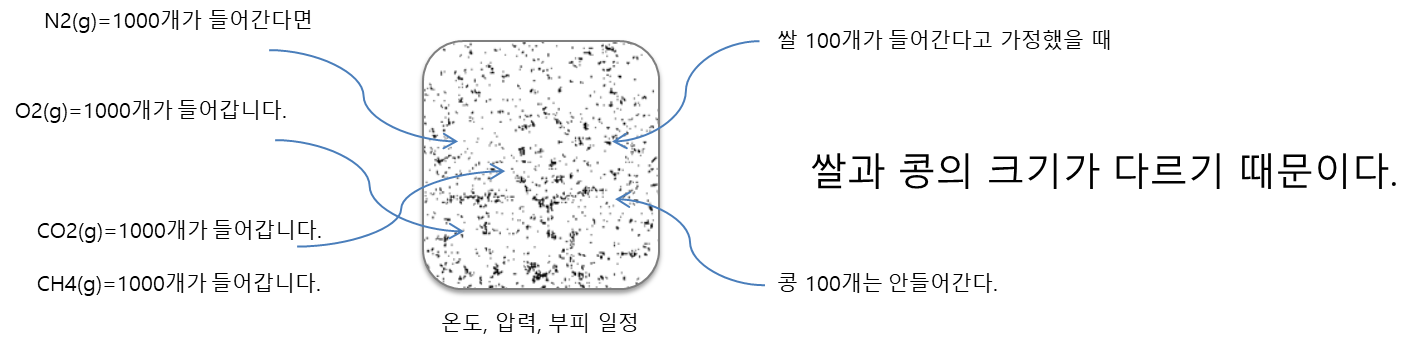
기체 분자 N2가 1000개가 들어간다면 다른 분자들도 같은 수만큼 들어갑니다.
여기서 질소원자는 2000개가 들어가는 것이고 산소 분자의 산소 원자는 2000개, 이산화탄소 분자의 원자는 3000개, 메탄의 원자는 5000개가 들어가는 것입니다.
결론은… 원자는 같은 수가 들어가지 않고 오로지 분자만이 같은 수가 들어갑니다.
0도씨, 1기압, 22.4l 안에 어떤 기체를 넣어도 같은 분자수가 들어가는데…. 이 특수한 조건에서는 1 mol이 들어갑니다.
22.4L가 1mol이 아닙니다… 0도씨, 1 기압(STP=표준상태) 하에서 가능한 것입니다.
지금까지 몰과 질량, 몰과 부피를 알아보았는데요.
몰을 중심으로 질량과 부피를 자유롭게 왔다 갔다 할 수 있습니다. 간다한 예제를 가지고 설명하겠습니다.
예제 1) STP 상태에서 CO2(g)가 22.4L 있을 때 이 안에 분자의 질량은?
표준상태에서 기체는 22.4L에서 1몰이고 분자의 질량은 44g이 됩니다.
예제 2) STP 상태에서 CO2(g)가 22g 있을 때 이 안에 분자의 부피는?
몰과 질량에서 CO2분자는 ½몰입니다. 부피는 11.2L가 됩니다.
'■ 기초화학' 카테고리의 다른 글
| 화학반응식 만들기(계수 맞추는법, 미정계수법) (0) | 2021.06.19 |
|---|---|
| [몰과 화학반응식]을 이용하여 실험실에서 질량과 부피를 이용하여 실험가능 (2) | 2021.06.18 |
| 몰(mol)과 질량의 관계 그리고 아보가드로수 (0) | 2021.06.13 |
| 몰(mol)은 왜 필요한가? 몰의 개념 알기 1편 (0) | 2021.05.06 |
| 화학식(구조식, 시성식, 분자식, 실험식)과 화학식량(원자량, 분자량, 실험식량) (0) | 2021.04.24 |