■ 화학식
예시로 아세트산(초산)을 가지고 알아보겠습니다. 우리가 알고 있는 식초인데요.
화학식에는 구조식, 시성식, 분자식, 실험식이 있습니다.
1. 구조식
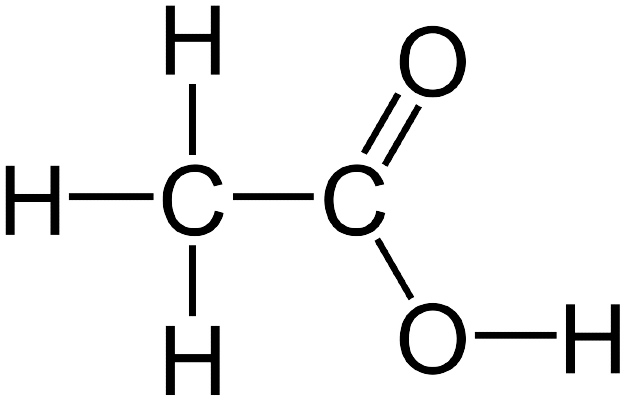
화합물의 분자 속에서 원자 또는 원자단의 결합 관계를 선으로 연결시켜 표시한 것인데요. 1개의 선은 1중 결합, 2개의 선은 2중 결합입니다.
2. 시성식

특수한 성질의 원자단이 분자 내에 존재함을 나타내는 화학식을 시성식이라고 합니다.
3. 분자식

분자를 구성하는 원자의 수를 원소기호를 써서 나타낸 식으로 물질을 이루는 분자의 짜임새를 나타낸다. 당연한 말이지만 분자만 분자식으로 표현 가능하다.
4. 실험식

화합물 내 원자를 가장 단순한 정수비로 나타낸 화학식
※ NaCl은 화학식이지 분자식이라 말하지 않는다. 하나의 분자가 아니고 1:1 성분비로 존재하는 것이기 때문에 실험식으로만 표현이 가능하다.
■ 화학식량
원자량은 원자의 상대적 질량입니다.
원자량과 질량수는 거의 비슷합니다.
∴ 원자량 ≒ 질량수(양성자 수+중성자 수)
=원자번호 ≒양성자 수
질량수는 양성자 수와 중성자 수를 합한 값인데요. 원자번호가 양성자 수 이고 중성자 수는 양성자 수와 거의 비슷합니다.
즉, 결론적으로 질량수는 대략 (원자번호 × 2)에 거의 가깝다는 것을 알 수 있습니다.
주기율표에서 질량을 확인해볼까요.

원자번호에 2를 곱한 값이 대략 질량수와 거의 비슷한 것을 볼 수 있죠?
원자량이라는 것은 원자의 상대적 질량입니다.
탄소를 기준으로 삼고 있습니다.

수소는 중성자가 없기 때문에 질량수가 1입니다. 아래 원자량 정도는 암기합시다.
H(1), He(4), C(12), N(14), O(16), Na(23), Mg(24), S(32), Cl(35.5), K(39), Ca(40)
분자량
O2(32), N2(28), H2O(18), CO2(44), NH3(17)
실험식량(화학식량)
NaCl(58.5)
'■ 기초화학' 카테고리의 다른 글
| 몰(mol)과 질량의 관계 그리고 아보가드로수 (0) | 2021.06.13 |
|---|---|
| 몰(mol)은 왜 필요한가? 몰의 개념 알기 1편 (0) | 2021.05.06 |
| [용어정리] 원소, 원자, 분자, 화합물, 분리, 분해 / 물질의 분류 (0) | 2021.04.24 |
| 원소 주기율표(기본 20개와 추가 4개)/ 옥텟규칙(8전자 규칙) (0) | 2021.04.19 |
| 원자 (0) | 2021.04.04 |