몰의 개념을 정확하게 이해하고 넘어가지 않으면 뒤로 갈수록 어려워지는 것이 화학의 특징입니다.
몰은 무엇인가요? 질문을 받으면 정확하게 설명할 수 있어야 합니다.
| 1 mol의 정의는? 1 mol = 원자번호 12번 탄소의 12g 중에 포함된 원자의 수 = 6.022 × 10²³개 |
몰과 질량은 어떤 관계에 있는가?
간단한 질문을 먼저 던져봅니다.
H2O 1개의 질량은?
.
.
.
.
18g이라고 답했다면 오답입니다.
몰과 개수를 혼돈해서는 안됩니다.
방금과 같이 H2O 18g은 1몰이 되고 1몰은 물분자 6.022 × 10²³개입니다.
18 / (6.022 × 10²³) 이렇게 해야 1개의 질량이 되겠죠.
몰과 질량의 관계에 대한 구체적인 설명을 다시 한번 정리해보았습니다.
몰은 개수 개념입니다.
개념의 흐름을 잘 잡아야 몰의 개념을 완벽하게 이해할 수 있습니다.
탄소 원자량 12에 g을 붙여서 12g 속에 들어 있는 원자의 수를 세어보니 6.022 × 10 ²³개이었고 이것을 1몰로 정했습니다.
다시 개념을 잡아보겠습니다. 이번에는 역으로~
탄소원자 6.022 × 10²³개를 모아서 질량을 달아보니 12g이었습니다.
원자량은 진짜 질량이 아닌 탄소를 기준으로 서로 비교하는 값이라는 것을 항상 염두에 두어야 합니다.
<몰과 질량 예시1>
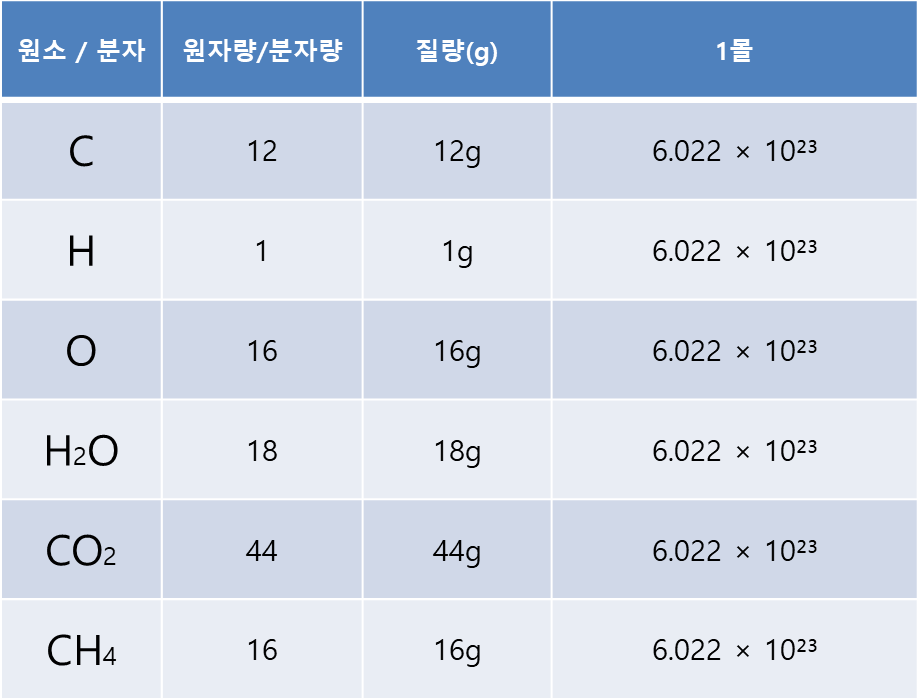
위에 탄소를 기준으로 각 원소와 분자의 원자량의 비례가 성립하려면 개수가 모두 동일해야 합니다.
여기에서 우리가 주입식으로 배웠던 하나의 공식이 탄생합니다.
mol = 질량 / (원자량 혹은 분자량)
위의 간단한 공식이 복잡한 숫자들이 나오는 문제에서는 아주 유용합니다. 공식은 무조건 암기하는 것이 좋습니다.하지만 왜 이런 공식이 나왔는지 정도는 알고 가야겠죠.
다음의 간단한 예시를 보실 때 원자와 분자를 철저히 구분해서 보시기 바랍니다.

분자의 몰 속에 원자의 몰을 계산하는데... 직관적으로 보이시죠...
마지막으로 <몰과 질량> 더 상세하게 설명하겠습니다.
연필 1 다스 =12개
계란 1판 = 30개
마늘 1접 = 100개
흔히 몰을 설명할 때 자주 등장하는 묶음 단위입니다.
이것은 왜 이렇게 단위가 정해졌는지 이유가 없습니다.
즉, 비과학적 영역이라는 것이죠.
하지만 1몰은 과학적 이유가 있습니다.
1몰 = 6 × 10 ²³개 (아보가드로수, NA)로 정한 이유는?
탄소 원자량 12는 단위도 없는 가짜 질량으로 임의로 붙인 것입니다.
탄소 12g이라고 표기한 것은 진짜 질량입니다.
연필심 같은 흑연을 저울에 올렸을 때 12g이라고 표기된 실제 질량을 뜻합니다.
이렇게 실제 탄소(흑연) 12g 속의 탄소원자 개수가 6 × 10 ²³개 있다는 말이고, 즉 1몰이 있다는 말입니다.
바꿔서 말하자면 탄소원자 개수가 6 × 10 ²³개가 있으면 실제 무게가 12g이 된다는 말입니다.
이것이 몰과 질량의 관계 기본입니다.
원소와 분자에 적용해보겠습니다.

이번에는 몰과 질량의 실제 관계가 어떻게 되는지 연습해보겠습니다.

mol = 질량 / (원자량 혹은 분자량)
위의 문제를 접해보니 공식이 필요하죠? 여기까지는 기본개념으로 머릿속으로 그냥 풀어질 수도 있지만 숫자가 더 복잡해지면 위의 공식이 필요합니다. 하지만 공식이 왜 이렇게 나왔는지는 알아야겠죠.
이렇게 다시 정리해보았습니다.
'■ 기초화학' 카테고리의 다른 글
| [몰과 화학반응식]을 이용하여 실험실에서 질량과 부피를 이용하여 실험가능 (2) | 2021.06.18 |
|---|---|
| 몰(mol)과 부피 (0) | 2021.06.14 |
| 몰(mol)은 왜 필요한가? 몰의 개념 알기 1편 (0) | 2021.05.06 |
| 화학식(구조식, 시성식, 분자식, 실험식)과 화학식량(원자량, 분자량, 실험식량) (0) | 2021.04.24 |
| [용어정리] 원소, 원자, 분자, 화합물, 분리, 분해 / 물질의 분류 (0) | 2021.04.24 |