원자란?
과거에는 더 이상 쪼개지지 않는 물질을 이루는 가장 작은 단위로 정의했는데
현대 과학에서는 더 쪼개질 수 있다.
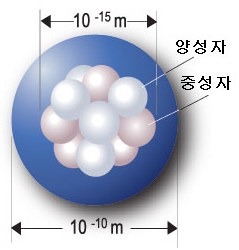
원자는 원자핵과 전자로 이루어져 있으며, 원자핵은 중성자와 양성자로 구성된다.

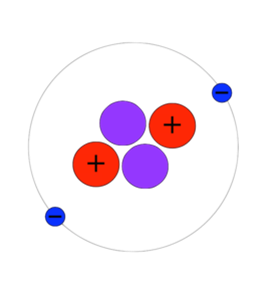
1. 원자는 통으로 봤을 때 중성을 띈다 : 양성자 수(원자번호) = 전자 수
양성자 수와 전자수는 동일하다. 그리고 양성자 수는 원자번호로 사용된다.
양성자 수로 원자번호를 결정하게 된 것은 양성자 수는 변화가 없기 때문이다.
그렇다면 전자 수로 왜 원자번호를 결정하면 안되는가? 전자는 자유롭게 왔다갔다 하기 때문에 기준이 되지 못한다.
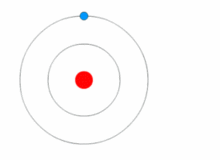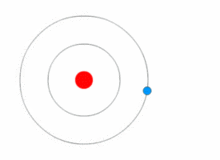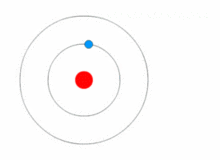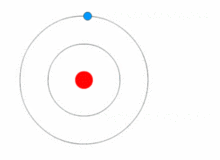 |
| 보어의 원자모형에서는 전자들이 에너지를 흡수 또는 방출하면서 궤도를 이동하는 "양자 도약"을 설명할 수 있다. |
2. 원자 표기법

● 질량수 : 원자들의 상대적이고 대략적인 비교된 수
<전제조건>
1) 원자의 질량수 = 양성자 수 + 중성자 수
(전자는 질량이 있지만 원자의 질량에 영향을 줄 수 없을 만큼 가벼워서 무시한다.)
2) 양성자 질량과 중성자 질량이 거의 비슷하다.
● 번호 : 양성자 수(원자번호) = 전자 수
<원소번호 11번 Na 원자 표기법 예시>
 |
 |
3. 동위원소 : 양성자 수는 같으나 중성자 수가 달라 결과적으로 질량수가 다른 원소
예시) 수소 동위원소

| 수소 | 중수소 | 삼중수소 | 물리,화학적 성질 | |
| 양성자수 | 1 | 1 | 1 | 화학적 성질 같다. |
| 중성자수 | 0 | 1 | 2 | 물리적 성질 다르다. |
| 질량수 | 1 | 2 | 3 | 물리적 성질 다르다. |
| 존재비율(%) 지구의 모든 곳에서 동일안 비율 |
99% | 1% | 자연계에 없음. |
예시) Cl (염소)
 |
 |
* Cl 평균 원자량이 35.5
'■ 기초화학' 카테고리의 다른 글
| 몰(mol)과 질량의 관계 그리고 아보가드로수 (0) | 2021.06.13 |
|---|---|
| 몰(mol)은 왜 필요한가? 몰의 개념 알기 1편 (0) | 2021.05.06 |
| 화학식(구조식, 시성식, 분자식, 실험식)과 화학식량(원자량, 분자량, 실험식량) (0) | 2021.04.24 |
| [용어정리] 원소, 원자, 분자, 화합물, 분리, 분해 / 물질의 분류 (0) | 2021.04.24 |
| 원소 주기율표(기본 20개와 추가 4개)/ 옥텟규칙(8전자 규칙) (0) | 2021.04.19 |