본론으로 들어가기 전에 기초적인 식과 그래프의 관계를 살펴보자.

1. 위의 식에서 A와 B의 관계를 그래프로 나타내면 아래의 그래프가 된다.

A와 B의 관계를 보려면 나머지 C, D, E, F는 상수 취급한다.

AB = k
AB는 일정한 값을 가진다.
즉, A와 B는 반비례 관계이다. B의 어떤 값을 넣더라도 그래프 위의 값은 AB가 일정한 값을 가진다.
다음과 같이 크기가 모두 같다.
2. 위의 식에서 A와 E의 관계를 그래프로 나타내면 아래의 그래프가 된다.

A와 E의 관계를 보려면 나머지 B, C, D, F는 상수 취급한다.
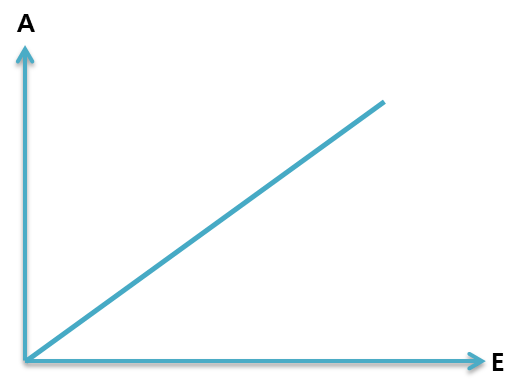
A = kE
A와 E는 비례관계이다.
3. 위의 식에서 A와 E의 관계를 그래프로 나타내면 아래의 그래프가 된다.

AB와 B의 관계를 보려면 나머지 C, D, E, F는 상수 취급한다.

AB = k
1번과 3번은 같은 내용이다.
단지 그래프의 표현 방식만 달라진 것이다.
일직선은 어떤 B의 값에도 AB는 일정한 값을 가진다는 의미이다.
이상 기체 상태 방정식을 이용한 기체의 그래프 종합정리
PV = nRT




위의 모든 그래프는 이상 기체일 때만 가능하다. 실제 기체와는 다르다.
그렇다면 실제 기체에서는 어떻게 달라지는지 확인해보자.
이상 기체와 실제 기체
앞의 이상 기체 그래프 중에 마지막 그래프로 설명한다.

이 그래프에서 알 수 있듯이 어떤 압력을 대입해도 1이라는 숫자가 일정하게 나온다.
단, 이상 기체일 때만 가능한 것이다.
그렇다면 실제 기체에서는 어떻게 되는지 실제 실험한 값을 그래프에 대입해보면 다음과 같은 그래프가 된다.
(실험은 실제 기체에 압력을 바꿔가면서 실제 어떤 값이 나오는지 그래프에 넣은 것이다.)
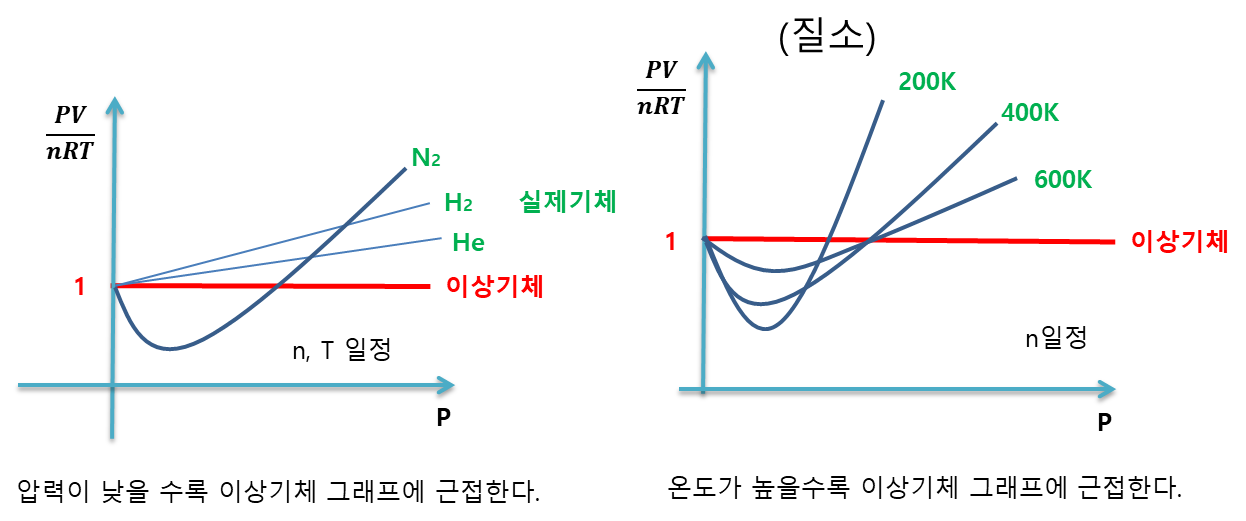
왼쪽 그래프에서 수소와 헬륨을 제외하고 모든 실제 기체는 질소처럼 그래프가 내려갔다가 올라간다.
그래서 오른쪽 그래프는 질소만 가지고 압력과 온도 변화에 그래프가 어떻게 변하는지 보여준다.
<결론>
실제 기체는 압력이 낮을수록 온도가 높을수록 이상기체에 근접한다.
구간을 나누어서 더 세밀하게 살펴본다.
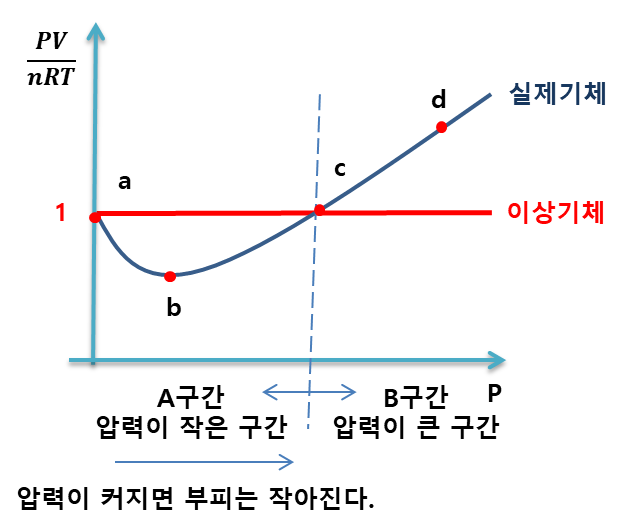
>> A구간
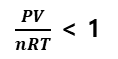
(nRT는 일정)
A구간에서 실제기체는 압력이 증가할 수록 부피가 이상기체보다 더 작아졌다는 의미이다.
그래서 1보다 작은 것이다.
이유 : 분자 간 인력 때문에 이러한 현상이 나타난다. 실제 기체는 압력을 가하면 분자 간 인력 때문에 서로 더 가까워져서 이상기체보다 작아지는 것이다. (이상기체는 분자간 인력이 없다.)
>> B구간

(nRT는 일정)
B구간에서 실제기체는 압력이 증가할 수록 부피가 이상기체보다 더 작아지지 않았다는 의미이다.
그래서 1보다 큰 것이다.
이유 : 분자 간 반발력과 분자 자신의 크기 때문에 이러한 현상이 나타난다. 실제 기체는 압력을 가하면 자기 자신의 크기에 충분히 근접했기 때문에 더 이상 가까워지기 힘들기 때문이다. 그래서 덜 줄어드는 효과가 나타난 것이다.
(이상기체는 크기가 없다.)
실제 기체는 압력이 증가하면 분자 간 거리가 줄어든다. 분자 간 인력이 증가하는 동시에 반발력도 증가한다.
'■ 기초화학 > ▷ 기체' 카테고리의 다른 글
| 이상 기체 상태 방정식을 이용한 분자량 알아내기 (0) | 2021.07.12 |
|---|---|
| 돌턴의 부분압력 법칙 (1) | 2021.07.10 |
| 기체 확산속도 [온도와 질량(분자량)] / 평균운동에너지와 평균운동속도 (2) | 2021.07.08 |
| 이상 기체(상태) 방정식 (PV = nRT) / 보일의 법칙, 샤를의 법칙, 아보가드로 법칙, 이상기체상수 R (0) | 2021.07.06 |
| 아보가드로 법칙 (0) | 2021.07.04 |