실험실에서 실제 실험으로 채취한 어떤 기체의 분자량을 이상 기체 상태 방정식으로 알아내 보자.
이상 기체 상태 방정식 PV = nRT
기체에서는 원자가 아닌 모두 분자를 다룬다. 즉, 여기에서 n(몰수)은 분자수를 의미한다.

여기에서 n을 이상 기체 상태 방정식 n에 대입해본다.

여기에서 분자량 M으로 다시 정리해보면

이상 기체 상태 방정식에서 기체 상수 R 값 0.082를 사용하려면 P, V, T 단위를 기체 상수 단위와 맞춰야 한다.
즉, 압력은 atm, 부피는 L, 온도는 절대온도 T를 사용해야만 한다.
부탄가스 분자량 알아내기

▽기체 모으는 방법
<기체 모으는 방법>
1. 수상 치환
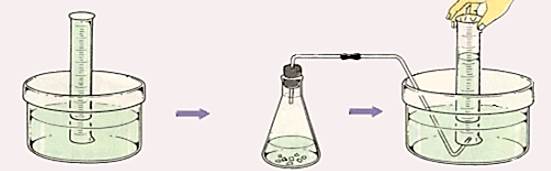
가장 많이 사용하는 방법으로 눈금 메스실린더에 물을 가득 채워 기포가 안 들어가게 뒤집어서 물속에 담근다.
그림과 같이 기체가 나오는 관을 넣어 기포를 채집한다. 물에 녹는 기체에는 사용할 수 없다.
포집되는 기체의 부피를 실린더 눈금으로 바로 확인이 가능하다는 장점이 있다.
2. 상방치환과 하방치환
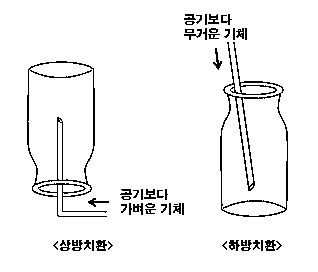

1. 절대온도 T
원래 부탄가스의 온도를 넣어야 하는데 그럴 수 없기 때문에 대신 물의 온도를 넣는다.
부탄과 물이 접촉하고 있어서 열적 평형이 된다. 즉, 물과 부탄의 온도가 같다고 본다.
2. 부피 V
메스실린더의 눈금을 읽으면 된다. 물의 수면 높이와 실린더 안의 물의 높이를 일치시켰을 때만 가능하다.
3. 질량 W
W1-W2를 사용. 부탄가스 통의 처음 질량에서 가스를 뺀 다음 질량을 빼주면 메스실린더 안의 가스 양이 나온다.
4. 압력 P
메스실린더 안에는 부탄가스 압력과 물에서 증발한 수증기의 압력이 있다.
즉, 메스실린더 안은 혼합기체 상태이다. 메스실린더 안의 부탄 압력 = 대기압 – 수증기 압력
여기서 수증기 압력은 물의 온도에 대한 수증기압의 표를 보면 알 수 있다.
사염화탄소 분자량 알아내기
사염화탄소는 상온에서 액체상태인데 기체로 변환해서 사용한다.

<실험과정>
둥근 플라스크 용기에 호일을 씌우고 입구를 단단히 막은 후 입구에 작은 바늘로 구멍을 낸다.
사염화탄소는 상온에서 액체 상태이다. 사염화탄소의 끓는점이 76.72 °C이다.
사염화탄소 액체를 플라스크에 넣고 중탕으로 기체화 한다.
기체가 되면 플라스크 안의 압력이 대기압과 같아질 때까지 사염화탄소 기체가 일부 빠져나간다.
대기압과 일치했을 때 플라스크를 꺼내어 냉각시켜 기체가 된 사염화탄소를 다시 액화시킨다.
그런 다음 플라스크 용기 무게를 측정한다.

1. 절대온도 T
원래 사염화탄소의 온도를 넣어야 하는데 그럴 수 없기 때문에 대신 물의 온도를 넣는다.
물과 사염화탄소가 접촉하고 있다고 보고 열적 평형으로 본다. 즉, 물과 사염화탄소의 온도가 같다고 본다.
2. 부피 V
둥근 플라스크의 부피이다. 플라스크 안에 물을 가득 채운 다음 메스실린더에 넣어 부피를 측정한다.
3. 질량 W
기체상태인 플라스크를 꺼내서 냉각시킨다. 그러면 사염화탄소가 다시 액체상태가 된다.
처음 액체상태에서 기체로 만들 때 내부 압력이 더 높으면 작은 구멍 사이로 빠져나가고 대기압과 같은 압력이 되면 더 이상 나가지 않는다.
그런 다음 냉각시켰기 때문에 기체 상태의 양이 그대로 액체가 된 것이다. 냉각시킨 용기 전체 질량을 W2라고 했을 때 사염화탄소의 질량은 W2-W1이 된다.
* 기체 상태의 둥근 플라스크 용기 무게를 측정하여 사용하면 안 되는 이유?
빈용기 질량:W1 = 빈용기 질량 + 내부 공기질량
냉각시킨 플라스크 질량: W2 = 빈용기 질량 + 내부 공기질량 + 액체 사염화탄소 질량
기체 상태의 플라스크 용기 안에는 공기질량이 없기 때문에 빈용기 질량을 빼면 내부 공기질량만큼 오차가 생긴다. 그래서 사용할 수 없다.
4. 압력 P
압력은 대기압을 사용한다. (구멍이 뚫려 있기 때문이다.)
'■ 기초화학 > ▷ 기체' 카테고리의 다른 글
| 이상 기체 상태 방정식을 이용한 기체의 그래프 종합정리(이상기체와 실제기체) (0) | 2021.07.14 |
|---|---|
| 돌턴의 부분압력 법칙 (1) | 2021.07.10 |
| 기체 확산속도 [온도와 질량(분자량)] / 평균운동에너지와 평균운동속도 (2) | 2021.07.08 |
| 이상 기체(상태) 방정식 (PV = nRT) / 보일의 법칙, 샤를의 법칙, 아보가드로 법칙, 이상기체상수 R (0) | 2021.07.06 |
| 아보가드로 법칙 (0) | 2021.07.04 |