◆ 보어의 원자 모형
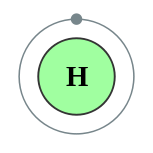
원자의 구조를 마치 태양계처럼 양전하를 띤 조그만 원자핵 주위를 전자들이 원형 궤도를 따라 돌고 있는 것으로 묘사하는 원자 모형이다.
수소원자의 선 스펙스럼은 보어의 모형을 증명한다.
스펙트럼의 종류와 에너지 관계를 살표보고 선 스펙트럼이 왜 보어의 전자 모형을 증명하는지 알아본다.
그전에 보어의 전자 모형에서 전자의 궤도와 에너지 관계부터 알아본다.

전자가 바깥 껍질로 갈수록 에너지가 높다.
이 세상 모든 물질은 에너지를 작게 가지려고 한다.
수소는 전자를 하나 가진다. 수소원자를 가만히 놔두면 전자는 K껍질에 존재하려 한다.
K껍질속이 가장 에너지가 작은 안정한 상태이기 때문이다. 이것을 바닥상태라고 한다.
K껍질에서 에너지를 흡수하면 L껍질로 전자가 이동한다. 이것을 들뜬상태라고 한다.
이 상태에서 그대로 놔두면 전자가 에너지 차이만큼 에너지를 방출(빛의 형태)하면서 바닥상태로 돌아간다.
※ 결론 1) 이 빛을 분광기에 통과시켜보면 에너지의 크기를 알 수 있다.
※ 스펙트럼이란?
빛을 파장에 따라 전개시켜 놓은 것.
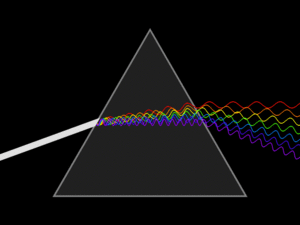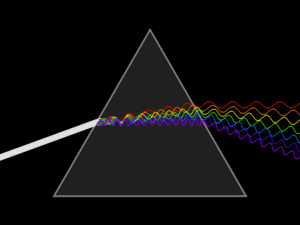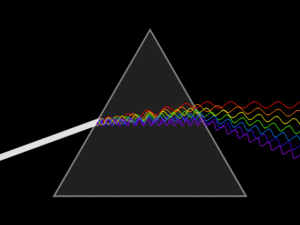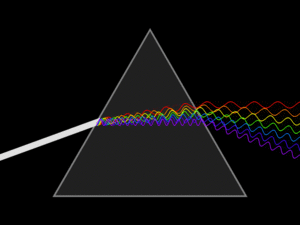
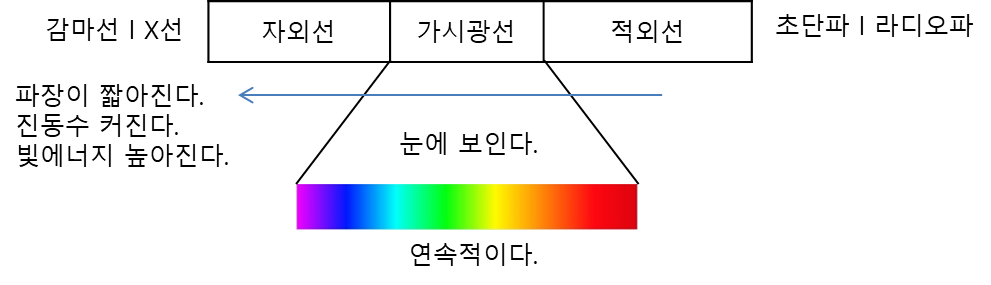
-연속 스펙트럼 : 모든 에너지 연속적으로 모두 찍혀서 나온다.
-선 스펙트럼: 특정 에너지 빛을 통과시키면 그 영역에서 선으로 찍혀서 나온다.
(빛 에너지의 크기를 확인할 수 있다.)

※ 결론 2) 어떤 에너지의 빛을 통과시켰을 때 찍히는 선을 보고 에너지값을 알 수 있다.
결론 1과 2에서 다음의 결론을 얻을 수 있다.
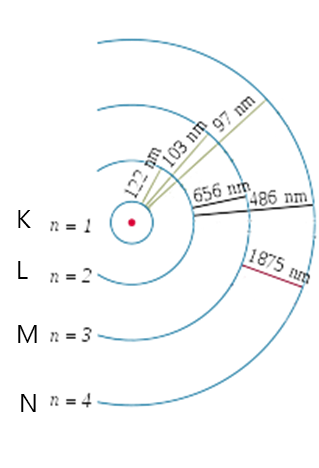
엄청 많은 수소원자가 에너지를 흡수해서 K, L, M, N껍질까지 전자가 분포되어 들뜬상태가 되었다고 가정하고 그대로 놔두면 바닥상태가 될 때 발산되는 빛을 분광기에 통과시키면 선 스펙트럼이 나온다.
나올 수 있는 에너지의 경우의 수가 6개로 선 스펙트럼에서 선의 개수가 6개가 나타난다.
이 실험에서 알 수 있는 것은 러더퍼드가 생각한 원자핵 주변에 전자가 아무 곳에 분포할 수 있다는 것이 틀렸다는 것을 증명한다. 만일 러더퍼드가 주장한 것이 맞다면 선 스펙트럼이 아닌 연속 스펙트럼이 찍혔을 것이다.
즉, 보어가 생각한 원자 모형(전자가 궤도에 존재한다)이 옳았다는 것을 증명해 보인 것이다.
'■ 기초화학' 카테고리의 다른 글
| 산화 / 환원 정의, 반응성 (0) | 2021.08.05 |
|---|---|
| 보어 / 에너지 준위, 스펙트럼 (0) | 2021.08.04 |
| 원자핵 발견 / 러더퍼드(알파입자 산란실험) (0) | 2021.08.02 |
| 전자의 발견 / 톰슨의 음극선 실험 (0) | 2021.08.02 |
| 원자론의 발전 / 돌턴의 원자설 (0) | 2021.08.02 |