농도란?
"용액의 진한 정도"로 간단하게 정의할 수 있습니다.
그렇다면 용액이란 무엇인가?
용매 + 용질 → 용액
용해
용매는 녹이는 물질로 간단한 예로 "물"을 생각하시면 됩니다.
용질은 녹는 물질로 간단한 예로 "소금"을 생각하시면 됩니다.
용액은 용매와 용질이 용해라는 과정을 거쳐 서로 합쳐진 상태를 말합니다.
1. 퍼센트 농도는 실생활에서는 주로 많이 사용되고 있지만 화학에서는 잘 사용하지 않습니다.

예시) 물 100g, 소금 20g 용해하면

2. 몰농도는 화학에서 주로 사용합니다.

화학에서는 몰농도를 주로 사용한다고 했는데요 그렇다면 왜 주로 몰농도를 사용할까요?
A + 2B → C 라는 화학반응식이 있다면 여기에서 우리는 계수비를 알 수가 있습니다.
계수비 : 반응하는 분자수비(몰수비)로 위의 화학반응식에서 1:2:1이 됩니다.
몰수비는 분자의 수를 의미하는데요. 몰농도는 용액 속에 얼마나 많은 수의 분자가 들어가 있는가를 알 수 있습니다.
퍼센트 농도는 용액 속에 얼마나 많은 질량이 있는지 따지는데요. 질량이 크다고 분자수가 많다는 것을 의미하지 않습니다.
몰농도와 퍼센트 농도는 서로 기준이 다릅니다.
예시1) 용질 4mol, 용액 1000mL

예시2) 용질 5mol, 용액 2L
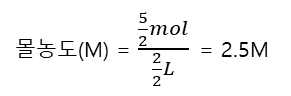
3. 몰랄농도

예시) 용매 1kg, 용질 2mol
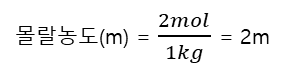
'■ 기초화학' 카테고리의 다른 글
| 탄화수소 분류와 예시 / 탄소수 명칭에 결합종류에 따른 명칭 붙이는 방법 (학술명) (0) | 2021.07.28 |
|---|---|
| [탄화수소] 기초 개념과 분류 / 분류별 구조식 (0) | 2021.07.27 |
| 동위원소 (0) | 2021.06.22 |
| 화학반응식 만들기(계수 맞추는법, 미정계수법) (0) | 2021.06.19 |
| [몰과 화학반응식]을 이용하여 실험실에서 질량과 부피를 이용하여 실험가능 (2) | 2021.06.18 |